时间:2026-01-16 10:55
阿尔茨海默病(AD)至今仍是一种病因复杂、难以治愈的神经退行性疾病。除了遗传、年龄等不可控因素外,近年来科学研究发现,睡眠障碍与AD的发病风险息息相关。
近期发表在《Current Neurology and Neuroscience Reports》(2025)的一篇综述系统性地回顾了这一领域的最新进展,为我们揭示睡眠如何成为预测和干预AD的关键窗口。
一、睡眠测量与AD风险
1.睡眠时长
睡眠时长与AD之间呈非线性“U形”关系,睡眠过短(<4小时)与过长(>8小时)均与AD风险增加相关;异常睡眠时长与大脑结构变化相关,睡眠过长(>7小时后每多1小时)与大脑体积缩小相关。睡眠模式的长期变化可能是早期识别AD高危人群的关键:长期睡眠时长的高度波动性可能加剧老年人的认知衰退,从短/中等时长转变为长睡眠时长本身即与加速的认知衰退相关,在床上时间持续增加以及每日总睡眠时间延长(≥9小时/天)的现象,可能在痴呆诊断前12年就已出现。此外,与睡眠稳定的人群相比,5年内日间嗜睡程度加重的个体其痴呆风险翻倍。
年龄特异性风险:
70岁以上:睡眠>8小时患AD的风险是睡7-8小时人群的2倍。
70岁以下:睡眠过短(<7小时)痴呆风险显著增高。
50-60岁:随访25年的研究发现,中年睡眠不足(≤6小时/天),会使晚年痴呆发病率显著提升。
2.昼夜节律
昼夜节律紊乱与AD之间存在密切关联:双向、复杂且相互作用;动物模型中,紊乱的睡眠-觉醒周期和时钟基因表达失调已被证明会加速β-淀粉样蛋白的聚集、沉积以及tau蛋白的磷酸化;人类中,昼夜节律紊乱先于痴呆症发病,并可能参与AD的发病机制,通过可穿戴设备测量的24小时节律完整性,可能作为神经退行性疾病的早期标志物。老年人日间活动幅度降低和24小时活动水平下降与更高的AD风险及更严重的认知衰退相关
3.睡眠剥夺
睡眠剥夺会增加β-淀粉样蛋白的沉积和tau蛋白的磷酸化;不同类型的睡眠剥夺(如一晚或多晚连续、完全或部分的睡眠剥夺)会导致海马体和丘脑中β-淀粉样蛋白负荷增加,并使血浆或脑脊液中包括Aβ38、Aβ40、Aβ42、磷酸化tau蛋白(p-tau)和总tau蛋白在内的生物标志物水平升高;在中年人群中,单晚的睡眠剥夺就可使夜间脑脊液中的Aβ40和Aβ42水平增加约10%;急性睡眠剥夺也会增加健康年轻成人血浆中的总tau蛋白水平,并可能破坏调节tau蛋白位点特异性磷酸化的生理过程,从而导致与早期神经退行性变相关的磷酸化tau蛋白形式产生;持续的睡眠不足会影响整体认知表现,尤其是持续性注意力,并且连续多日累积的渐进性神经认知功能下降与睡眠不足的严重程度相关,持续、充足的睡眠(每晚≥7小时)能增强工作记忆和反应抑制能力,而每晚减少1.5小时的睡眠则会损害预期的认知能力获益。
4.主观与客观睡眠质量
自述存在睡眠障碍的个体相比没有此类主诉的人,罹患AD的风险更高;主观睡眠质量差与认知功能受损、主观认知能力下降以及痴呆症发病风险升高相关;睡眠效率比总睡眠时间更能预测AD风险,睡眠碎片化指标,如入睡后清醒时间(WASO)、频繁长时间醒来以及夜间活动增加,也与认知能力下降和更高的AD风险相关;夜间睡眠质量差(在床上时间更长、入睡潜伏期延长、入睡后清醒时间增加以及睡眠效率降低)会增加AD风险,而补偿性的日间小睡则与风险降低相关;睡眠碎片化和夜间清醒会削弱睡眠对神经退行性变的保护作用,并增加AD风险。
5.睡眠阶段与睡眠潜伏期
慢波睡眠对记忆巩固和大脑健康至关重要,慢波睡眠丧失是痴呆的风险因素;评估痴呆风险时,应关注慢波睡眠占比随时间的下降趋势,而非个体间的瞬时差异。这种下降在APOE-ε4携带者中更快;快速眼动睡眠减少与AD患者的认知障碍相关,无认知障碍的APOE-ε4携带者已显示出快速眼动睡眠比例和时长的降低,提示其作为早期生物标志物的潜力;快速眼动睡眠占比低的健康老年人,未来顶下叶(AD早期易受累区)萎缩风险更高,快速眼动睡眠潜伏期延长与AD核心病理标志物(Aβ斑块、p-tau)增加直接相关,且独立于其他睡眠参数。
6.微观结构睡眠测量
睡眠微观结构活动(如慢波活动、纺锤波)对认知和记忆至关重要,睡眠微观结构改变与AD生物标志物(Aβ、tau)水平升高相关,可能先于认知障碍出现,慢波活动减少、睡眠纺锤波密度降低可预测晚年的Aβ和tau负荷,慢波-纺锤波/θ波耦合异常与脑脊液生物标志物变化及更差的认知轨迹相关,脑电图谱功率异常:σ、α、θ波绝对功率增加可在诊断前至少五年出现,快慢波功率比异常(如β/θ比异常)和快速眼动睡眠期脑电减慢有潜力作为鉴别MCI的生物标志物。较高的慢波活动比例可能在Aβ负荷高的个体中起到防止记忆损伤的保护作用。动物模型提示慢波损伤先于斑块沉积,但人类研究中δ波与Aβ积累的关系存在不一致,可能与随访时间差异有关,需更长期的纵向研究。
二、几种常见睡眠障碍与AD的关联
睡眠障碍 | 与AD风险的关联 |
失眠 | 风险升高约1.5倍;部分安眠药(如苯二氮䓬类)可能进一步增加风险 |
阻塞性睡眠呼吸暂停(OSA) | 风险升高1.2–1.6倍;尤其在携带APOE-ε4基因的人群中影响更显著 |
白天过度嗜睡/嗜睡障碍 | 可能与神经炎症、HPA轴失调及遗传风险相互作用,增加AD风险 |
不宁腿综合征(RLS) | 部分研究提示其与全因痴呆、血管性痴呆及AD风险升高相关 |
三、睡眠改变与AD病理机制的见解
睡眠与AD之间存在双向关联,睡眠障碍影响AD风险,AD病理也可能加剧睡眠问题,睡眠模式紊乱、慢波睡眠和快速眼动睡眠改变、睡眠质量差以及昼夜节律失调均会对AD风险产生负面影响(见图1)。睡眠时长不足或过长,以及睡眠碎片化,都可能随时间推移导致认知衰退。
类淋巴系统可能是睡眠障碍与AD病理生理之间关联的一个潜在中介。该系统是大脑在睡眠(特别是慢波睡眠期)中清除代谢废物(如Aβ)的关键途径。这个依赖胶质细胞的大脑废物清除系统,利用由表达水通道蛋白-4水通道的星形胶质细胞终足形成的脑血管周围间隙,并通过脑脊液振荡,特别是在非快速眼动睡眠期的慢波活动期间,促进长距离循环和大脑废物清除。AQP4基因的遗传变异(特定的单核苷酸多态性)与睡眠质量下降和β-淀粉样蛋白负荷增加有关。睡眠障碍和昼夜节律失调可能通过改变血管周围星形胶质细胞终足中AQP4通道的极化状态,从而阻碍类淋巴流,并促进淀粉样蛋白积累和tau蛋白沉积。
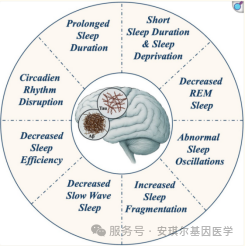
图1 睡眠异常与阿尔茨海默病风险升高相关
阻塞性睡眠呼吸暂停主要通过两种路径增加AD风险:第一种机制主要由夜间间歇性低氧(通过AHI、ODI或低氧饱和度时间占比衡量)驱动,其次是慢波睡眠减少和睡眠期间交感神经张力增加。间歇性夜间低氧通过氧化应激、神经炎症、线粒体功能障碍及多种代谢紊乱,导致神经元死亡增加,进而促使Aβ产生增多,同时作用于淀粉样前体蛋白的神经保护酶活性降低。第二种机制可用类淋巴系统功能受损来解释,其原因包括慢波睡眠减少、频繁自主神经激活性觉醒及胸腔内压增高,这些因素共同损害Aβ的清除。除了直接影响Aβ的产生与清除动力学外,这两种通路还会导致睡眠结构的显著改变。
睡眠碎片化与夜间低氧对AD病理的不同负面影响主要在AD动物模型中得到研究。暴露于慢性间歇性低氧后,携带突变型人淀粉样前体蛋白和早老素1基因的AD模型小鼠(APP/PS1小鼠)表现出空间学习和记忆缺陷以及海马长时程增强功能障碍;而短暂间歇性低氧则被发现与Aβ过度产生和tau蛋白磷酸化均相关,但不引起行为变化。另一方面,关于慢性睡眠碎片化的研究结果存在矛盾,有报道称其可能影响tau蛋白系统或淀粉样蛋白系统。
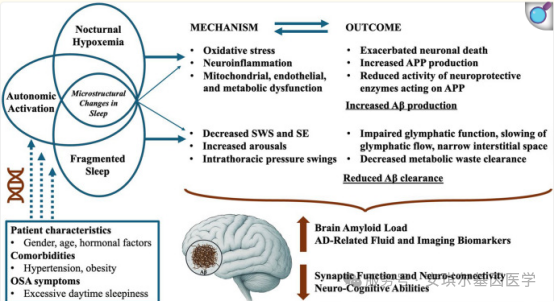
图2 阻塞性睡眠呼吸暂停患者大脑中β-淀粉样蛋白积累的机制假说
四、结论
将睡眠作为AD的可调控风险因素,为早期检测、预防和干预开辟了充满希望的道路。随着可穿戴技术和睡眠监测工具的普及,将睡眠指标纳入常规健康评估,有助于早期识别高危个体。未来的研究应侧重于大规模、纵向的研究,以验证基于睡眠的生物标志物,并探索针对睡眠结构和昼夜节律调节的个性化干预措施。此外,增强慢波睡眠和快速眼动睡眠的治疗策略,以及针对失眠和阻塞性睡眠呼吸暂停等睡眠障碍的治疗,不仅有望缓解症状,还可能改变神经退行性病变的进程。最终,结合遗传、睡眠和生物标志物信息的精准医学方法,有望显著提升我们对AD风险的预测和调控能力。