来源: NEJM医学前沿
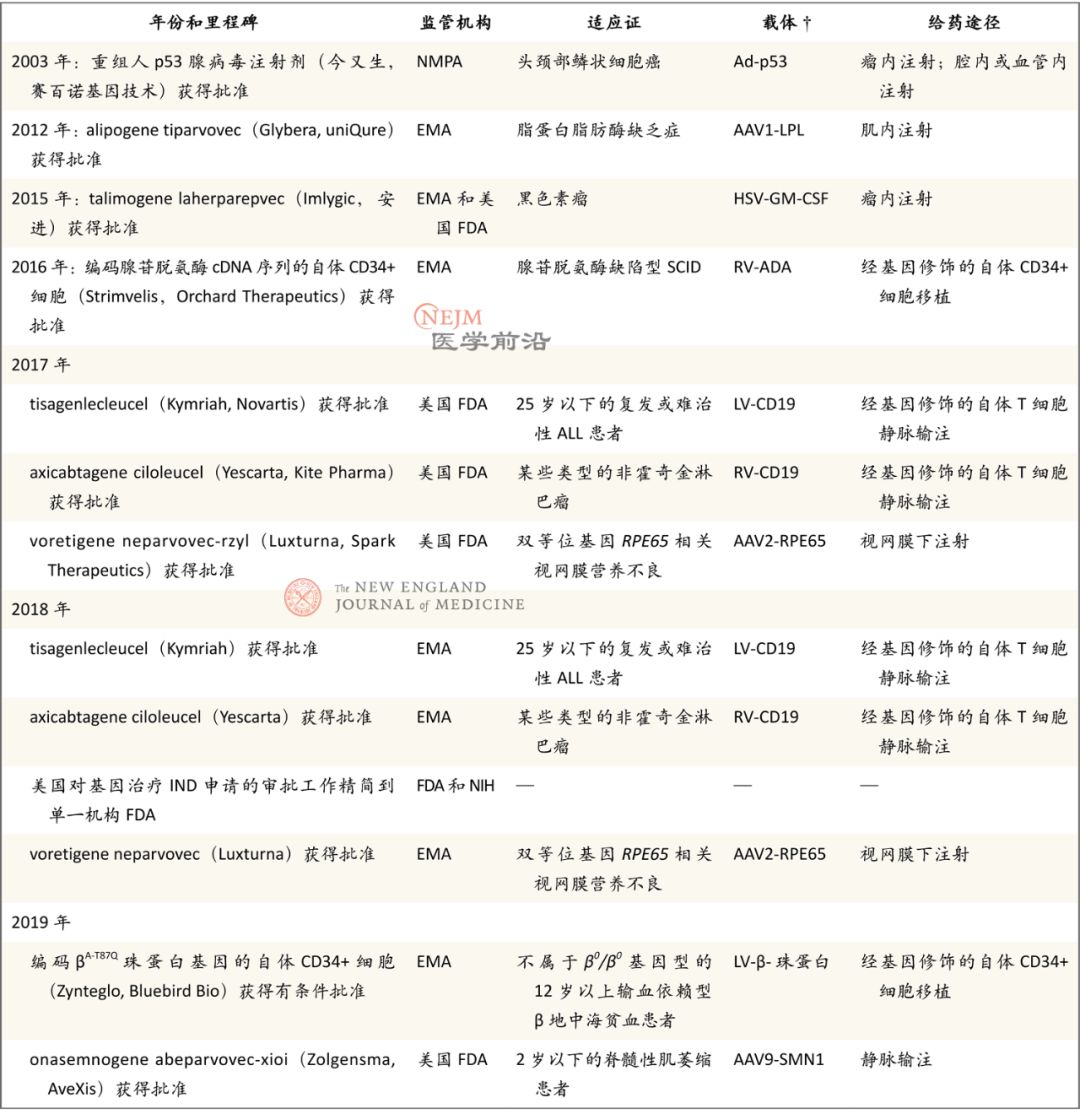
基因治疗为传统疗法无效的疾病提供了可选择的治疗方案。自2016年以来,欧洲EMA和美国FDA已批准总共6种基因治疗产品:两种属于CAR T疗法,用于治疗血液肿瘤;4种用于治疗严重单基因遗传病,包括β地中海贫血、一种罕见的视力减退、脊髓性肌萎缩和一种罕见的原发性免疫缺陷。
目前有800多种细胞和基因治疗项目正在临床开发中(其中包括进行性假肥大性肌营养不良和亨廷顿病等既往无法治疗的疾病)。
2019年8月1日,《新英格兰医学杂志》发表了题为《基因治疗》的综述,介绍了基因治疗的基本原理、临床应用以及亟需解决的挑战等,重点关注单基因疾病(High KA, Roncarolo MG. Gene therapy. N Engl J Med 2019;381:455-64)。
我们在此介绍该文部分内容,文中图片均源自NEJM综述原文。阅读全文翻译,请点击本文开头微信小程序图片或文末“阅读原文”,访问《NEJM医学前沿》官网(www.nejmqianyan.cn)或APP。本文介绍的基因疗法,主要针对罕见病。点击文末视频,让我们听听一位北京协和医院的骨外科医生关于科研的感想。他专注骨科罕见病,曾以第一作者在NEJM发表论著。
基本原理
基因治疗的目标是实现治疗性基因或“转基因”的持久表达,在最少不良事件的前提下使其水平足以改善或治愈疾病症状。
1. 将整合载体导入前体细胞或干细胞内,使基因可以传给每个子细胞(载体被设计为可以在患者染色体的一个或多个基因座整合)

图1. 基因治疗的离体递送
2. 通过非整合载体将基因递送到长期存活的有丝分裂后细胞或缓慢分裂的细胞内,确保该基因在细胞存活期间持续表达
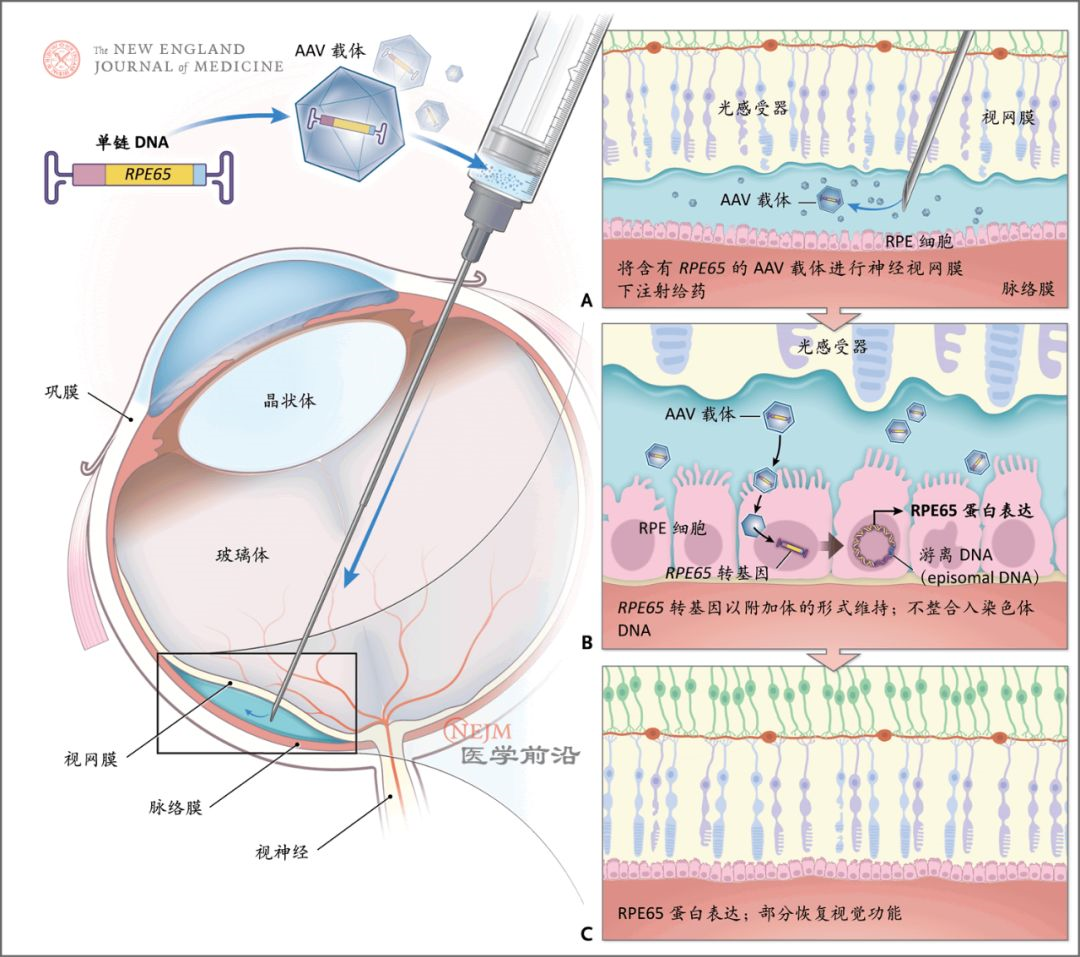
图2. 基因治疗的体内递送
第2种方案不需要将治疗性DNA整合入患者细胞的染色体,而是转移的DNA在染色体外达到稳态。干细胞转导通常为离体操作,并且需要整合载体,而将基因递送给长期存活的有丝分裂后细胞的过程通常是通过体内基因递送的方式实现。
将基因治疗应用于遗传病,绝不仅仅是确定致病基因。转基因(或其蛋白质产物)必须被递送到生理上相关的一个或多个靶组织,必须稳定表达,并且绝不能干扰这些细胞的功能完整性。
整合载体(例如逆转录病毒载体)的主要风险来自其插入诱变潜力,即载体插入细胞DNA并破坏该DNA的功能元件(例如基因)。体内给药载体的主要风险来自对载体的免疫应答。对于这两种风险,前者已通过制造更安全的(慢病毒)载体来降低或规避,因为慢病毒和腺相关病毒(AAV)载体不具有持续复制的能力;而后者则已通过辅助性免疫调节药物来降低。
表1. 基因治疗的潜在并发症和观察到的并发症*
* AAV表示腺相关病毒,SCID表示重度联合免疫缺陷。

近期的β地中海贫血患者干细胞基因治疗的1期和2期试验表明其可安全地降低患者输血频率。临床疗效与基因转移效率、转导细胞中的前病毒平均拷贝数以及经基因矫正的造血干细胞剂量相关,与血红蛋白合成需求呈负相关。
这两项试验之一以及正在进行中的3期研究(关于编码变异βA-T87Q-珠蛋白基因的载体)表明,患者在长达56个月期间不需要输血,被视为疗效持久,因此EMA有条件地批准了Zynteglo(蓝鸟生物)用于治疗≥12岁,且不属于β0/β0基因型的输血依赖型β-地中海贫血患者。靶向不同基因、利用不同载体治疗镰状细胞性贫血的4项基因治疗试验正在进行中(ClinicalTrials.gov注册号为NCT03282656、NCT02247843、NCT02186418和NCT02151526)。
表2. 基因治疗的监管审批里程碑
体内基因转移(将载体直接注射到患者体内)大多使用AAV载体作为基因递送载体。重组AAV载体是利用一种非致病性无包膜细小病毒构建而成。制备载体的方式是将由适当启动子驱动的治疗性基因置于两个非编码病毒包装信号之间(图2),但当序列长度超过5 kb时,将转基因包装入载体中的效率急剧下降,这是AAV载体递送系统的少数几个局限性之一。大部分AAV载体DNA在细胞内以稳定附加体的形式持续存在(未整合入患者基因组)。因此,AAV载体发生插入诱变的风险低。
以肝脏或其他器官为目标对AAV载体进行的全身性血管内给药已经在数种重度遗传病中获得了正面的临床结局。对重组AAV载体血管内给药开展的一项早期试验纳入了男性重度血友病B患者。
1. 20%~40%成人存在AAV抗体,它可中和载体,进而降低疗效
2. 在输入载体后4~12周发生的对AAV衣壳的迟发型细胞免疫应答,会导致转导细胞遭到破坏和丧失疗效
上述两个问题的根源是人类是野生型AAV的天然宿主,因此可能携带儿童期呼吸道感染后产生的抗体或记忆T细胞。
目前,有AAV抗体的患者无法接受治疗。而迟发型细胞免疫应答的临床表现是无症状、自限性的转氨酶水平升高,同时来自转基因的因子Ⅸ表达逐渐丧失。对外周血单核细胞所做的检测表明,它们针对AAV衣壳肽分泌干扰素-γ,因此人们认为通过药物进行免疫抑制可能有助于AAV载体发挥疗效,因为衣壳肽的存在时间应该很短。
这一看法被另一项试验证实。该试验中发生转氨酶水平升高或因子Ⅸ水平降低的参与者接受了逐渐减量的糖皮质激素治疗。试验中输入最大剂量糖皮质激素的6名参与者在3年观察期内表现为因子Ⅸ长期表达,并且出血事件和因子Ⅸ用药量均减少90%。
之后的一项试验采用了因子Ⅸ的高比活性变异体,因而可以采用较小剂量(早期试验中所采用的大剂量的1/4),并且达到的因子Ⅸ平均活性水平要高得多,而免疫应答的发生率较低,这可能是因为免疫应答具有剂量依赖性。
由于可以整合入AAV载体的cDNA长度存在限制,因此对于由F8这种非常大的基因突变引起的血友病A,研究者花了较长时间才启动针对基因治疗的临床试验,而正在进行的临床试验利用了编码截短因子Ⅷ的cDNA。
近期的一项试验对其前9例患者的报告显示,在接受最大剂量载体的7名男性中,20周时有6名的因子Ⅷ活性水平为12%~200%以上(50%~150%代表正常活性水平),但其随时间推移而下降(随访3年以上)。因子Ⅷ水平的下降,以及因子Ⅷ的错误折叠倾向(错误折叠可能导致细胞应激)令人质疑血友病A患者可否实现持久应答。尽管如此,在2~3年内观察到的患者年出血率的降低仍然是稳健的。
对于离体基因治疗,未来的目标包括改进慢病毒载体的设计,以进一步提高安全性和对外源基因的控制,高效大规模制备并分析鉴定载体,以及开发毒性较低且有助于稳定植入经过基因矫正的干细胞的预处理方案,包括用基于抗体的方案代替化疗预处理,从而减少并发症。
对于应用AAV载体进行的体内基因治疗,未来10年的努力将集中于阐明和管理人体对载体的免疫应答,并继续改进AAV载体的设计和开发,从而提高靶向能力并采用较小剂量达到体内疗效。



