时间:2024-11-01 16:43
来源:安琪尔基因医学
背景
癌症精准医学有利于癌症检测、癌症复发监测和个性化治疗。它关注的是如何将正确的药物与正确的患者相匹配。目前的癌症精准医疗主要基于基因组技术。然而,由于对癌症基因型和表型之间的关系了解不完全,只有一小部分携带已知功能突变的患者可以得到适当的治疗。此外,癌症与罕见的遗传性疾病的不同之处在于,它一直处于一个动态的复制驱动的微进化过程中。基因组技术反映的是描述性和静态信息,不能再现肿瘤的微观进化过程,对精准医学的预测价值有限。
功能测试,评估肿瘤细胞对治疗的动态敏感性,为癌症管理提供有价值的预测信息。第一代功能测试,即肿瘤活检样本直接暴露于药物中,并不普遍适用。该方法的临床试验数据不足,不足以支持其在临床实践中的可行性。人类癌症来源的细胞系是基本的癌症研究工具,因为它们易于培养和管理。然而,长期体外培养传代会积累癌细胞系的遗传变异,导致研究数据不一致甚至相互矛盾。患者源性异种移植(Patientderived xenograft, PDX)模型更准确地概括了原发肿瘤的特性,包括肿瘤结构、微环境和异质性。然而,PDX模型仍然存在许多阻碍其在研究和治疗中应用的缺点,例如耗时和昂贵的异种移植繁殖,伦理问题以及移植成功率低。
与其它功能测试模型不同,患者源性类器官(PDOs)是来源于患者肿瘤的3D培养物。传统的PDOs是从患者的肿瘤组织中建立的。它们有助于体外肿瘤微组织模拟,重建源组织的内部结构,是一种更有前途的临床前功能测试模型。与细胞系和PDX模型相比,PDOs代表了一种更容易和廉价的方法来完成个体化肿瘤研究。PDO概括了原始肿瘤的基因组和结构特征,并能够同时进行高通量功能测试。直到最近,已经成功地利用恶性肿瘤患者胸腔积液、腹水和外周血建立了类器官。特别是,外周血采集是非侵入性的,便于PDO培养。通过培养不同肿瘤分期患者外周血源性类器官,研究人员可以深入了解肿瘤进化谱的动态变化,从而监测肿瘤转移。
CTC来源类器官
循环肿瘤细胞(Circulating Tumor Cells, CTCs)是一种特殊的肿瘤细胞,它们从原发肿瘤或转移瘤脱落,进入血液循环,成为肿瘤扩散的潜在种子。CTC是肿瘤诊断和治疗的重要生物标志物。CTCs的转录组谱、DNA突变谱、信号状态、PD-L1表达水平和生物学功能可以反映原发或转移性病变的恶性程度。CTCs受到来自肿瘤细胞和微环境的多种因素的调节。大多数CTCs被免疫细胞(如NK细胞等)清除,只有一小部分CTCs能够存活。这些存活的CTC可以在血液中形成微小的肿瘤血栓并发展成转移性病变。总之,CTC源性类器官是一种很有前景的肿瘤模型。研究还发现CTC和免疫细胞的共培养不仅保留了肿瘤的异质性,而且有可能提高PDO培养的效率。
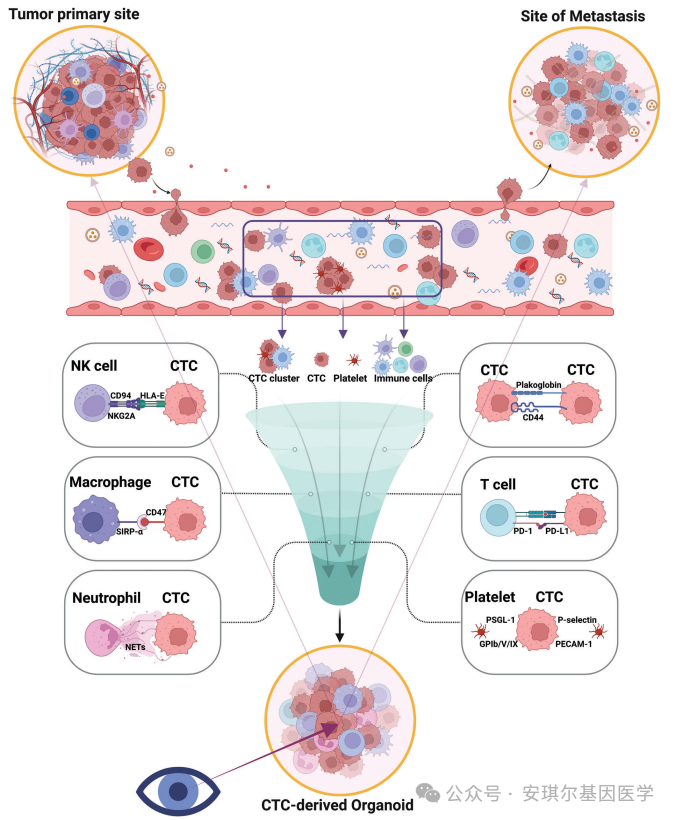
图1 CTC以及CTC来源类器官
CTC来源类器官的应用
CTC衍生的类器官可以准确地复制原位肿瘤特征,并动态跟踪肿瘤的发展。对不同进展阶段的CTC衍生类器官进行功能药敏检测,可以及时为临床用药提供最新有效的药物信息。外周血CTC衍生类器官的成功建立,反映了肿瘤细胞在患者血液循环中的高扩张能力,可以预测患者的复发和转移风险。此外,CTC衍生的类器官模型为评估联合治疗的有效性提供了重要的可行性。反复分析患者外周血中的CTC,可以动态监测新的耐药情况,探索潜在的耐药机制和治疗靶点。CTC与免疫细胞之间的相互作用为CTC的存活和定植提供了帮助,CTC衍生的类器官模型可以作为研究这种相互作用的工具。总之,CTC衍生的类器官在肿瘤的精准诊断和治疗方面具有很大的应用前景。
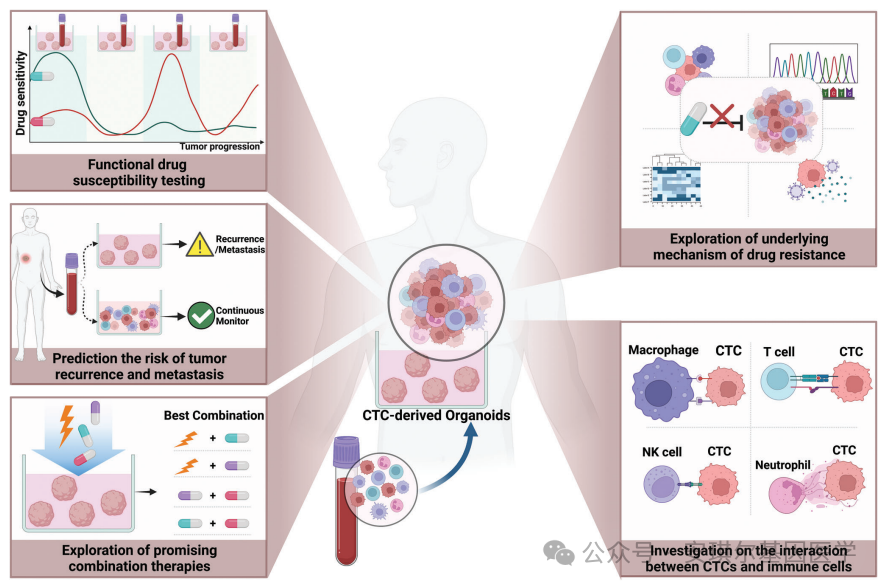
图2 CTC来源的肿瘤类器官的应用方向
结论与展望
肿瘤微环境、肿瘤内部和肿瘤间的异质性以及不断变化的肿瘤突变谱对精准医疗提出了越来越高的要求。类器官被认为是一个有前景的下一代功能测试平台,在体外复制三维肿瘤结构和维持与相应原发肿瘤相似的突变谱方面具有独特的优势。然而,来自肿瘤活检或手术样本的类器官不适合长期动态监测,并且在知情同意方面面临困难。因此,液体活检的类器官可能是更好的选择。
现有的液体活检技术基于已知的肿瘤标志物或突变信息提供临床指导和实时监测,代表了基因组学驱动的精准医学的延伸。CTC来源类器官,利用液体活检和类器官技术的双重优势,是液体活检技术走向临床的进一步补充,是有前景的下一代功能检测模式。CTC来源类器官在体外能更好地再现肿瘤特征,在预测患者复发转移风险、检测药物敏感性、探索联合治疗策略等方面具有广阔的临床应用前景。