1994年,美国加州大学洛杉矶分校的布来德森教授团队成功建立了AD体外神经细胞模型。通过“转染”技术,在细胞中插入与AD及其他神经退行性疾病相关的基因,随后展开观察。起初,细胞体似乎未受明显影响。然而,在培养皿中减少营养因子或添加有毒化合物时,正常细胞会全力抵抗以求存活,可被“转染”的细胞却纷纷死亡,且毫无抵抗之举。深入观察发现,这些细胞并非以传统方式死亡,而是激活了细胞凋亡程序,自我毁灭。在正常状况下,细胞凋亡属于自然的生命现象。但凋亡过度,或发生于错误的时间和地点,便会引发生理性缺陷或器官损伤,比如导致AD。引发AD的基因能够致使不正常的脑细胞“自杀”。大脑中的每个神经元都需在自身所占空间内接收外部信息。为此,神经元进化出“受体”。这些受体能够感知每个细胞外周(包括内部)的细微变化。有的受体能检测甲状腺激素、维生素D,有的对雌二醇敏感,还有的受多巴胺等影响。此类受体在无配体时,会诱导细胞凋亡;而被配体激活后,则能阻止脑细胞凋亡。这些受体称为“依赖受体”,迄今已发现21种。但是,若受体被其他反物质占据,即便存在配体,仍会导致脑细胞凋亡,β-淀粉样蛋白就属于这种反物质。APP是一种依赖受体,其是淀粉样前体蛋白,它从神经元(特别是突触附近的神经元)中产生。APP由695个氨基酸组成(其中淀粉样蛋白仅为一小部分,由40 个或42个氨基酸构成)。APP会被一种名为“蛋白酶”的“分子剪刀”剪开。若剪刀沿 3个特定入口(坏的入口)切入,会生成 4 个肽:sAPPβ(可溶性淀粉样前体蛋白β)、Jcasp、C31 以及β-淀粉样蛋白(Aβ)。这4个肽均参与了AD的病理过程,例如脑神经突触的损毁、使神经元与其他神经元连接的部分萎缩,以及激活神经元的自我凋亡程序。反之,若剪刀沿某一个入口(好的入口)切入,会产生2个肽:sAPPα(可溶性淀粉样前体蛋白α)和CTFα,它们能够维持突触的连接性,并阻止神经元的自我凋亡程序。当神经突触破坏因子(破坏性的4个肽片段)增多,超过了突触维持和形成因子(保护认知的2个肽片段),即突触发出的破坏信号强于改善信号时,就会引发AD。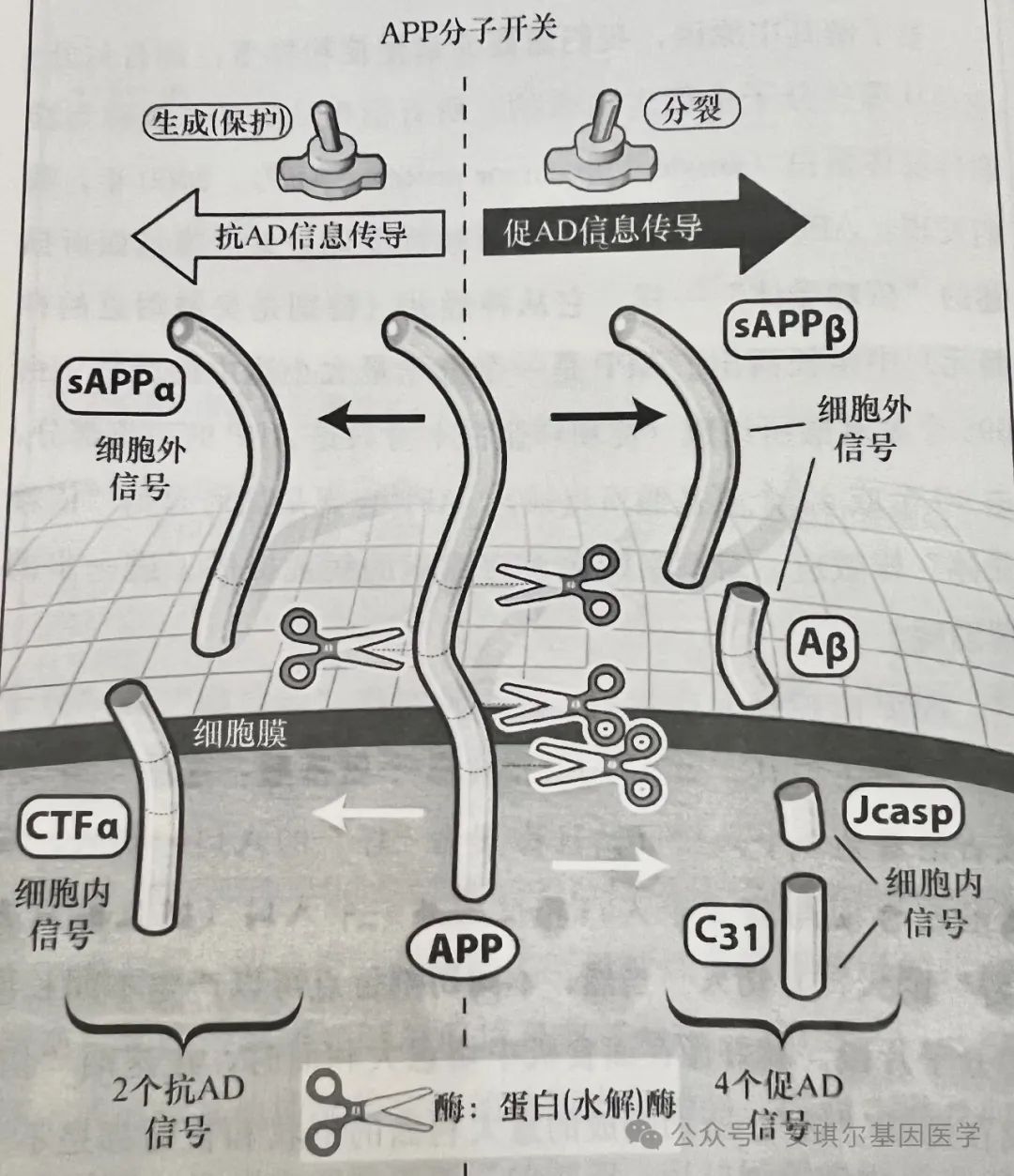
APP的切割点主要取决于它与何种分子结合。倘若APP与神经营养因子-1(netrin-1)结合,将在单个“切点”上进行切割,从而产生抗老年痴呆的sAPPα和CTFα。其结果会促进轴突生长,全方位呵护神经突触的健康,保护神经元,并防止脑细胞自我凋亡。若APP被Aβ缠住,就会在 3个“切点”上切割,进而产生促进AD的4个肽片段。而且,由APP裂解产生的Aβ能够再次与APP结合,生成更多的Aβ。因为APP是“依赖受体”!只要轻易地除去神经营养因子,“雪球”便开始滚动,产生β-淀粉样蛋白。
此外,影响APP的直接或间接因素众多,且均已被证实与AD的发生存在关联。比如雌激素、睾酮、甲状腺激素、胰岛素、炎症分子、核因子κ、沉默信息调节因子1、维生素D 等。还有一些因素,像睡眠状态和压力等。这些因素在AD的信号通路关键节点上,发挥着重要作用。
大脑拥有千兆亿的神经突触,哪些结构需要更好地运行?哪些需要更换?哪些应当退役?努力维持损毁/促进的平衡。然而,随着年龄增长,突触促进和维护所需的激素、营养因子等愈发稀缺,相应的受体将这一短缺信息传递给 APP,于是,与破坏性4个肽片段相关的指令更易扩散,大脑庞大的突触网络系统难以维持,只能通过战略性协调或缩减来弥补,“精兵简政”地保留生存必需的功能,以牺牲其他行为能力(如记忆力、理解力和想象力等)为代价来维系生命。
关注阿尔茨海默,早发现、早诊断、早干预。目前,安琪尔基因医学已开展阿尔茨海默早筛AD7C-NTP检测项目,为受检者及时提供后续健康管理服务,从而及早地发现潜在的AD风险,及早干预延缓病情,提高生命的质量。现在就行动起来,(点击)预约AD7C-NTP检测为您及家人构筑坚实的健康防线!
关注“安琪尔基因医学”公众号或扫描二维码关注—菜单栏—产品服务—(点击)AD早筛商城,便可下单进行检测,后台联系客服可领取优惠劵。